2023年12月12日,Science China-Life Sciences在线发表了复旦大学常芳课题组题为“Revealing the Role of CCoAOMT1: Fine-Tuning bHLH Transcription Factors for Optimal Anther Development”的研究论文。该研究揭示了一个新的翻译后水平调控机制:甲基转移酶CCoAOMT1通过促进bHLHs转录因子的出核降解而负调控bHLH089功能,从而有效阻止bHLHs下游花药绒毡层转录网络的有害过量,并最终确保花粉发育内稳态。

花粉作为被子植物的雄配子体,对植物有性生殖至关重要。正常的花粉发育受到环境和自身信号的双重调控。绒毡层是花药壁四层体细胞中直接靠近小孢子的一层,为小孢子提供花粉壁前体物质,对维持正常花粉育性至关重要,但长期以来对维持绒毡层内稳态的机制并不清楚。复旦大学常芳教授课题组前期研究曾揭示:花药绒毡层中的门控转录因子DYT1与其下游bHLH转录因子之间存在多个“前馈”和“正反馈”环路,这些反馈环路共同保障了绒毡层中与花粉壁前体物质合成途径相关的转录网络的精准调控和迅速放大(Zhu et al., 2015; Cui et al., 2016)。而众所周知,转录网络的过度放大会造成孢粉素合成的有害过量,反而破坏花粉发育,导致雄性育性下降。因此,及时“刹车”是必不可少的。
本次研究中,课题组揭示了一个直接作用于bHLH010/bHLH089转录因子的转录后层面的“刹车”途径:甲基转移酶CCoAOMT1直接作用于bHLH010/089转录因子保守的K259位点,促进bHLHs转录因子的出核及降解,从而通过减少bHLHs转录因子在细胞核的积累而有效抑制其下游基因的的表达,并最终确保花粉发育的内稳态。bhlh010/089突变体及bHLH89转基因过表达植株均表现出严重的花粉发育异常,表明bHLHs转录因子的内稳态对花粉发育至关重要。CCoAOMT1是课题组通过互作蛋白筛选鉴定到的一个与bHLH010、bHLH089均存在相互作用的甲基转移酶。课题组首先发现CCoAOMT1在生殖组织、特别是花药绒毡层细胞中高表达,且广泛分布于细胞膜、ER、及细胞核中;其转基因过表达植株表现出类似于bhlh010/089突变体植株的表型:果荚短小、花粉数目少且多数干瘪败育、花粉萌发率极低。进一步通过细胞、生化、遗传等试验联合分析发现:bHLH010/089转录因子自身特异地分布于细胞核中,而CCoAOMT1促进其出核降解;bHLH010/089转录因子保守的甲基化位点K259是CCoAOMT1作用的关键位点;将该位点突变后,bHLH089K59A的核分布不再受CCoAOMT1负调控,bHLH089K59A蛋白在细胞核内大量积累;将突变后的bHLH089(bHLH089K59A)转基因过表达至bhlh010/089突变体中,并不能像野生型bHLH089一样恢复突变体表型,而是使突变体表现出bHLH089过表达类似的表型;此外,bHLH089过表达所导致的花粉发育异常能够被CCoAOMT1过表达所恢复。以上结果综合解析了CCoAOMT1通过抑制bHLHs转录因子而维持花粉发育内稳态的分子机制。
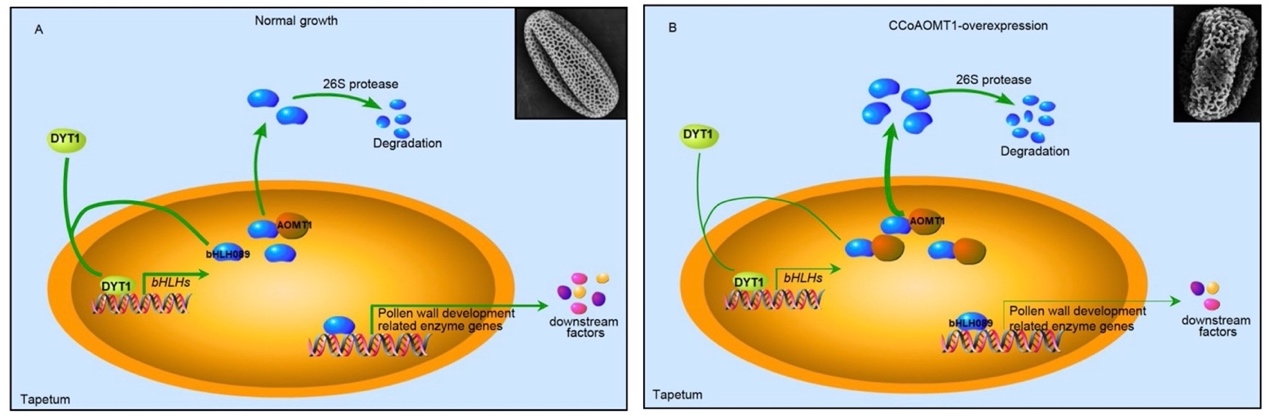
模型示CCoAOMT1在花粉发育过程中通过抑制bHLHs转录因子的有害过量而保障植物雄性育性。
A、 bHLH010/089/091 TF协同促进绒毡层门控转录因子DYT1的快速核积累。这种正反馈机制确保了绒毡层转录网络的快速放大。与此同时,CCoAOMT1识别并结合bHLH转录因子,通过K259位点抑制bHLH010/089的核定位,从而有效抑制bHLHs过量。DYT1-bHLH010/089/091“正反馈”环路及CCoAOMT1-bHLH089负调控途径共同维持花药绒毡层转录网络的稳态。B、 CCoAOMT1的过量表达,促进bHLH010/089过多的出核降解,并进而导致类似bhlh010 bhlh089双突变体植物的花粉发育受损。
复旦大学与海南大学联合培养博士生来泽森(现海南大学博士后)为论文的第一作者,复旦大学常芳教授为通讯作者。海南大学与中国热带农业科学院彭世清研究员、美国宾州州立大学马红教授、复旦大学博士研究生王健正、付营(现中科院植物分子卓越创新中心助研)、本科生王梦涵参与了该研究工作。上述研究工作得到了科技部重点研发计划、国家自然科学基金、及复旦大学国家级人才计划专项经费的资助。
至此,该课题组先后揭示了维持雄性育性的两种正向调控机制:前馈机制、正反馈机制;以及两条“刹车”途径:另一条通过绒毡层内部的甲基转移酶直接作用于bHLH转录因子而实现;另一条通过来自小孢子的CLEs小肽信号激活的跨膜信号传导而实现。
原文链接:https://doi.org/10.1007/s11427-023-2461-0

